Mục lục
Công thức oxit cao nhất của lưu huỳnh là oxit axit mạnh, đóng vai trò quan trọng trong lĩnh vực công nghiệp hiện nay. Với cấu trúc phân tử và tính chất hóa học độc đáo, hợp chất này trở thành đối tượng nghiên cứu thiết yếu trong hóa học vô cơ. Cùng IHOC.VN tìm hiểu chi tiết về dạng hợp chất này.
Công thức oxit cao nhất của lưu huỳnh là gì?
Công thức oxit cao nhất của lưu huỳnh chính là lưu huỳnh trioxit, được xem như một dạng oxit axit quan trọng. Hợp chất vô cơ ký hiệu ở công thức hóa học là SO3, anhydride lưu huỳnh. SO3 có thể tồn tại ở dạng chất lỏng không màu, khả năng hòa tan tuyệt đối đối với nước cũng như axit sunfuric.
Trong dạng khí, hợp chất SO3 là tác nhân dẫn đến việc ô nhiễm nghiêm trọng. Đây là một trong những nguyên nhân tạo nên hiện tượng mưa axit. Oxit cao nhất của lưu huỳnh được sản xuất với số lượng và quy mô lớn, nhằm mục đích hợp chất chính để sản xuất axit sunfuric.
Những đặc điểm xác định hợp chất SO3 chính xác
Để nhận biết và xác định chính xác SO₃ là oxit cao nhất của lưu huỳnh, cần dựa vào ba tiêu chí quan trọng sau:
Theo nguyên tắc về oxit: Oxit nguyên tố thuộc dạng thông thường oxit bazơ, ngược lại oxit nguyên tố thuộc dạng phi kim sẽ là oxit axit. Đối với trường hợp của SO3, lưu huỳnh được xác định thuộc nhóm phi kim, đồng nghĩa SO3 chính là oxit axit.

Trạng thái của oxi hoá của lưu huỳnh: Nhận biết SO3 nổi trội với trạng thái oxi hóa +6, đây là trường hợp oxi hóa cao bởi vì tính acid mạnh từ oxit axit.
Tính chất acid của SO3: Đặc điểm quan trọng của SO3 có thể tương tác mạnh với H2O, sau đó sẽ tạo thành hợp chất axit sunfuric hay còn gọi là H2SO4. Thông qua điều này, có thể kết luận SO3 chắc chắn là một oxit axit.
Tính chất vật lý của SO3
SO₃ (lưu huỳnh trioxit) có những tính chất vật lý đặc trưng và thay đổi theo điều kiện nhiệt độ, áp suất. Dưới đây là phân tích chi tiết của Ihoc.vn về các tính chất vật lý của SO₃ trong các điều kiện khác nhau.
Ở điều kiện thường: Khi gặp phải điều kiện thường, công thức oxit cao nhất của lưu huỳnh sẽ ở trạng thái chất lỏng không màu. Nhờ vào tính hút nước vô cùng mạnh, nên tạo thành H2SO4 hoặc H2.SO4.nSO3.
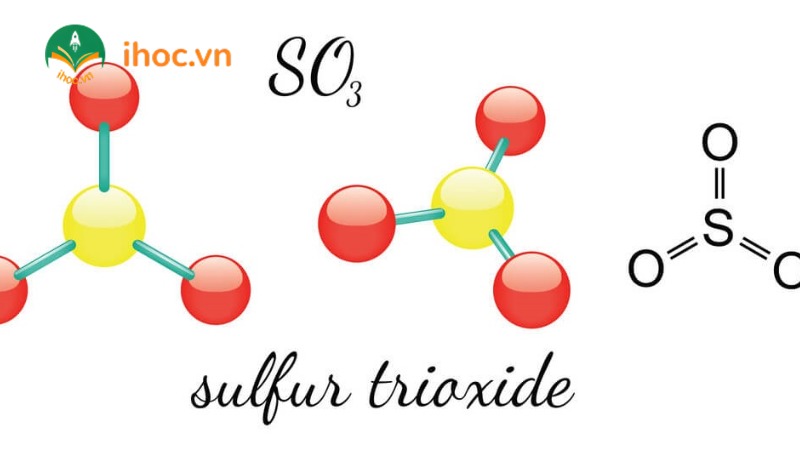
Điều kiện khác: Để hợp chất oxit axit SO3 có thể nóng chảy, bắt buộc nhiệt độ chính xác là 17 độ C. Trong khi đó, nhiệt độ sôi của SO3 là 45 độ C.
Tính chất hoá học của SO3
SO3 là một oxit axit, do đó thể hiện đầy đủ tính chất như oxit axit thông thường. Bao gồm:
Tính oxit axit đặc trưng
Oxit axit có các tính chất hóa học đặc trưng sau:
- Tác dụng với nước: SO3 + H20 → H2SO4 (axit sunfuric)
- Tác dụng với bazơ: SO₃ + 2KOH → K₂SO₄ + H₂O (kali sunfat)
- Tác dụng với oxit bazơ: SO₃ + Na₂O → Na₂SO₄ (natri sunfat)
Tính oxi hoá mạnh
Oxi hóa phi kim SO₃ có khả năng oxi hóa một số phi kim, kim loại và hợp chất khử mạnh ở nhiệt độ cao:
- 2SO₃ + S →(t°) 3SO₂
- SO₃ + C →(t°) SO₂ + CO
- 2SO₃ + 2Na → Na₂SO₄ + S
- SO₃ + H₂S → S + H₂O + SO₂
- SO₃ + 2HI → I₂ + H₂O + SO₂
Điều chế SO3
Điều chế công thức oxit cao nhất của lưu huỳnh có thể thực hiện trong 2 phương pháp như sau:
Trong phòng thí nghiệm
Đối với phòng thí nghiệm, điều chế SO3 bằng 2 cách như sau:
Nhiệt phân muối sunfat
Nung nóng muối sunfat của một số kim loại ở nhiệt độ cao để tạo SO₃:
Fe₂(SO₄)₃ →(t°) Fe₂O₃ + 3SO₃↑
2FeSO₄ →(t°) Fe₂O₃ + SO₂↑ + SO₃↑
CuSO₄ →(t°) CuO + SO₃↑
Nhận xét: Phương pháp này đơn giản nhưng hiệu suất thấp và khó thu được SO₃ tinh khiết.
Nhiệt phân muối sunfat
Oxi hóa SO₂ bằng O₂
SO₂ được oxi hóa bởi oxi không khí với xúc tác và nhiệt độ thích hợp: 2SO₂ + O₂ ⇌ 2SO₃ (xúc tác: V₂O₅, t° = 450-500°C). Điều kiện:
Xúc tác: V₂O₅ (vanadi(V) oxit)
Nhiệt độ: 450-500°C
Áp suất: áp suất thường hoặc tăng nhẹ
Nhận xét: Phương pháp này cho hiệu suất cao hơn và dễ kiểm soát.

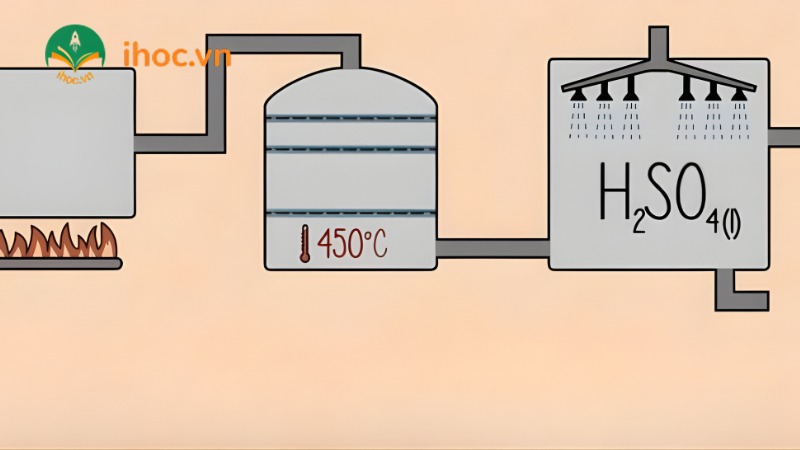
Trong công nghiệp
Sản xuất SO₃ trong công nghiệp diễn ra qua 3 giai đoạn chính:
Đốt S hoặc quặng pirit: S + O₂ →(t°) SO₂, 4FeS₂ + 11O₂ →(t°) 2Fe₂O₃ + 8SO₂
Oxi hóa SO₂ thành SO₃: 2SO₂ + O₂ ⇌ 2SO₃ (xúc tác: V₂O₅, t° = 450-500°C)
Hấp thụ SO₃ bằng H₂SO₄ đặc: SO₃ + H₂SO₄ → H₂S₂O₇ (oleum), H₂S₂O₇ + H₂O → 2H₂SO₄
Ứng dụng của công thức oxit cao nhất của lưu huỳnh
SO₃ là nguyên liệu quan trọng nhất trong sản xuất H₂SO₄ công nghiệp, chính vì thế hợp chất được áp dụng rộng rãi hiện nay.
Sản xuất Axit Sunfuric
SO₃ là nguyên liệu quan trọng nhất trong sản xuất H₂SO₄ công nghiệp theo phương pháp tiếp xúc:
SO₃ + H₂SO₄ → H₂S₂O₇ (oleum)
H₂S₂O₇ + H₂O → 2H₂SO₄
H₂SO₄ là một trong những hóa chất công nghiệp quan trọng nhất, được sử dụng rộng rãi trong nhiều ngành công nghiệp.
Sử dụng trong sơn và lớp phủ
SO₃ và các dẫn xuất của nó được ứng dụng trong công nghiệp sơn:
Sản xuất chất hoạt động bề mặt (surfactant) cho sơn
Tạo chất phủ chống ăn mòn, chống thấm
Cải thiện độ bền và độ bóng của lớp sơn
Sản xuất sợi Terylene
SO₃ và H₂SO₄ được sử dụng trong quá trình tổng hợp polyester (Terylene – PET):
Xúc tác phản ứng trùng hợp giữa axit terephtalic và etylen glycol
Tạo ra sợi tổng hợp bền, dai, không nhăn dùng trong dệt may

Sản xuất Muối Sunfat
SO₃ được dùng để sản xuất các loại muối sunfat công nghiệp:
SO₃ + Na₂O → Na₂SO₄ (natri sunfat)
Sản xuất phèn, muối sunfat kim loại khác
Ứng dụng trong công nghiệp giấy, thuỷ tinh, chất tẩy rửa

Trong sản xuất động cơ đốt trong
H₂SO₄ (từ SO₃) được sử dụng trong sản xuất và bảo dưỡng ắc quy:
Chế tạo ắc quy axit-chсвинец (Pb-H₂SO₄)
Điện phân dung dịch H₂SO₄ để tinh chế kim loại
Xử lý bề mặt kim loại trước khi lắp ráp
Trong sản xuất phân bón
H₂SO₄ (từ SO₃) là nguyên liệu thiết yếu trong sản xuất phân bón:
Ca₃(PO₄)₂ + 2H₂SO₄ → Ca(H₂PO₄)₂ + 2CaSO₄ (sản xuất superphosphate)
Sản xuất phân đạm: (NH₄)₂SO₄ (amoni sunfat)
Xử lý quặng photphat để tạo phân lân
Khoảng 60-70% lượng H₂SO₄ thế giới được dùng cho sản xuất phân bón

Bài tập vận dụng về SO3
Dưới đây là một số bài tập giúp củng cố kiến thức về tính chất, điều chế và ứng dụng của công thức oxit cao nhất của lưu huỳnh.
Câu 1: Cho SO₃ tác dụng với CaO, sản phẩm thu được là:
A. CaSO₃
B. CaSO₄
C. Ca(HSO₄)₂
D. CaS
→ Đáp án đúng là B.CaSO4
Câu 2: Nhận biết SO₃ trong hỗn hợp khí
→ Đáp án:
Bước 1: Dẫn hỗn hợp khí chứa SO₃ qua dung dịch BaCl₂ (Bari clorua) hoặc Ba(NO₃)₂ (Bari nitrat).
Bước 2: Hiện tượng: Nếu có khí SO3, SO3 sẽ phản ứng với hơi nước có trong không khí hoặc dung dịch để tạo thành axit sunfuric (H2SO4).
Bước 3: Sau đó, H2SO4 sẽ phản ứng với BaCl2 (hoặc Ba(NO3)2) tạo thành kết tủa trắng không tan trong axit mạnh (như HCl hoặc HNO3).
Câu 3: Viết phương trình hóa học và cho biết vai trò của SO₃ trong các phản ứng sau:
a) SO₃ tác dụng với nước
b) SO₃ tác dụng với dung dịch NaOH
c) SO₃ tác dụng với H₂S
d) SO₃ tác dụng với CaO
→ Đáp án:
a.SO3+H2O⟶H2SO4
b.Tỉ lệ nSO3:nNaOH≤1: Tạo muối trung hòa
SO3+2NaOH⟶Na2SO4+H2O
Tỉ lệ nSO3:nNaOH≥1: Tạo muối axit
SO3+NaOH⟶NaHSO
c.SO3+3H2S⟶(t°)4S+3H2O
d.SO3+CaO⟶CaSO4
Bài viết trên đã cung cấp những nội dung chi tiết liên quan đến công thức oxit cao nhất của lưu huỳnh. Hy vọng rằng với kiến thức hữu ích của Thư viện điện tử Ihoc, người đọc có thể tích lũy thêm nhiều thông tin hỗ trợ trong quá trình học tập. Hãy theo dõi trang web chúng tôi để nâng cao kho tàng học tập mỗi ngày.




 Bài viết mới
Bài viết mới
